| |
 |
|
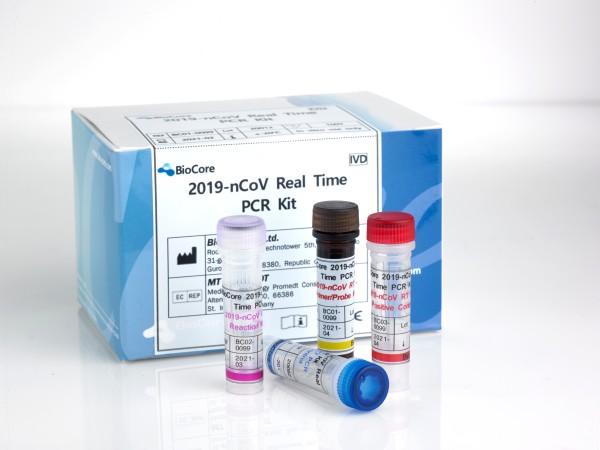
| ▲ 바이오코아 코로나19 진단키트./사진=바이오코아 |
[미디어펜=김견희 기자]분자진단 전문 기업 바이오코아는 코로나19 진단키트가 식품의약품안전처로부터 긴급사용 승인을 획득했다고 밝혔다. 코젠바이오텍, 씨젠, 솔젠트, SD바이오센서, 바이오세움에 이어 여섯 번째다.
바이오코아에 따르면 'BioCore 2019-nCoV Real Time PCR Kit'는 세계보건기구(WHO) 가이드라인에서 권고하는 RT-PCR 방식의 진단키트로, N과 RdRp 두 가지 유전자 부위를 한 개의 튜브로 증폭하여 사용편의성을 높인 제품이다.
앞서 4월부터 바이오코아는 유럽CE 인증과 식약처 수출허가를 획득해 국내보다 앞서 독일, 이탈리아, 스페인, 인도, 가나 등 전 세계 20여 개국에 수출을 진행하고 있다.
바이오코아 측은 이번 긴급사용 승인을 통해 내수시장 진출과 더불어, 미국 FDA의 긴급사용승인(EUA) 절차 역시 승인이 임박하면서 미국시장 진출에도 본격적으로 박차를 가할 예정이다.
한편, 바이오코아는 2015년 코넥스 상장된 임상 및 분석을 아우르는 전문 CRO 업체다. 2001년 설립 이후 20여 년간 국내외 제약업계에 신약개발 전 과정에 걸친 통합적인 서비스를 제공하고 있으며 생명공학 분야에서도 축적된 경험과 유전체 진단기술을 바탕으로 유전체 검사 서비스 및 다양한 종류의 생명공학 진단관련 제품을 제공하고 있다.
[미디어펜=김견희 기자]
▶다른기사보기